В.Г. Лихванцева – д.м.н., профессор кафедры офтальмологии ФФМ МГУ имени М.В. Ломоносова;
К.А. Кузьмин – аспирант1;
Е.В. Коростелёва – аспирант2;
М.В. Соломатина – аспирант2;
С.В. Буданова – врач-офтальмолог3;
- ФФМ МГУ имени М.В. Ломоносова, кафедра офтальмологии, 119192, Российская Федерация, г. Москва, Ломоносовский просп., д. 31, корпус 5;
- ГБОУ ВПО «Рязанский государственный медицинский университет имени академика И.П.Павлова», кафедра глазных и ЛОР болезней, 390024, Российская Федерация, г. Рязань, ул. Высоковольтная, д. 9;
- ГБУ РО «КБ им. Н.А. Семашко», 390005, Российская Федерация, г. Рязань, ул. Семашко, д. 3;
Реферат
Цель: поиск и идентификация тиреоидных рецепторов в структурах глаза методом иммуногистохимического анализа (ИГХ).
Материал и методы: Объектом морфологических исследований стали энуклеированные глаза больных терминальной болящей глаукомой (n=30). Поиск тиреоидных рецепторов осуществляли в сетчатке и зрительном нерве, сосудах хориоидеи и зрительного нерва. ИГХ реакцию оценивали следующим образом: при отсутствии специфического окрашивания клеток или при наличии менее 10% окрашенных клеток от всей площади в зоне просмотра как отрицательная реакция, слабо положительная реакция считалась в случае окрашивания от 10 до 30% (+)клеток, умеренно положительная реакция в случае экспрессии маркера в 30 - 75 % (++) клетках и экспрессия маркера более 75% клеток расценивали как выраженную реакцию (+++).
Результаты: Интенсивная (4+) положительная ИГХ-окраска зафиксирована в ядрах наружного и внутреннего зернистого слоев сетчатки, в ядрах ганглиозных клеток; слабоположительная окраска (1+) во внутренних сегментах отростков фоторецепторных клеток. Гранулярная ИГХ-окраска (3+) обнаруживалась в ядрах глиальных элементов зрительного нерва. В хориоидее окрашивались ядра эндотелиоцитови ядра 20% клеток стромы сосудистой оболочки. ИГХ-реакция отмечалась в цитоплазме пигментного эпителия сетчатки.
Заключение: полученные нами ИГХ-данные объясняют механизм нейрогуморальную связь на клеточном уровне и позволяет считать орган-зрения – мишенью тиреоидных гормонов, обосновывая причины морфофункциональных изменений периферического отдела зрительного анализатора при заболеваниях щитовидной железы. Прозрачность финансовой деятельности: Никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Ключевые слова: иммуногистохимический анализ, тиреоидные рецепторы, нейрогуморальная связь.
Search and identification of thyroid hormone receptor in tissues of the eye
Resume
Purpose: Search and identification of thyroid receptors in eye structure by means of immune histological chemical analysis (IHC).
Methods: Enucleated eyes of the patients with the terminal diseased glaucoma (n=30) were the object of morphological research. The search of thyroid receptors was accomplished in the retina and visual nerve, vessels, chorial and visual nerve. IHC reaction was estimated as follows: the absence of specific cell colour or the presence of less than 10% of painted cells out of all examined area was considered as a negative reaction. A mild positive reaction was considered in case of painting from 10 to 30% (+cells). Moderate positive reaction is in case of the marker expression in 30-75% (++cells) and if the expression of the marker is more than 75%, it was considered as a pronounced reaction (+++).
Results: Intensive (4+) positive IHC was fixed in the nuclei of ganglionic cells; mild positive painting (1+) - in internal segments of appendixes of photoreceptor cells. Granule IHC painting was revealed in nuclei of glial elements of visual nerve. Endothellocyte nuclei of 20% of stroma cells of vascular membrane were painted in choroidea. IHC reaction was marked in cytoplasm of pigmented spot of retina epithelium.
Conclusion: Received IHC findings explain the mechanism of neurohumoral connection on cellular level, and it allows to consider the vision organ to be the target of thyroid hormones and explains the causes of morphofuncional changes in peripheral area of visual analyser in thyroid gland diseases. Financial Disclosure: No athor has a financial or property interest in any material or method mentiond.
Key words: immune histological chemical analysis, thyroid receptors, neurohumoral connection.
Несмотря на утверждение, что мишенями тиреоидных гормонов являются все ткани человеческого организма, убедительные морфологические доказательства экспрессии специфических высокоаффинных рецепторов, связывающих трийодтиронин (Т3) и тироксин (Т4), представлены только для клеток печени, почек, мозга, яичек, селезенки и гипофиза [1-5]. Наиболее изученной представляется экспрессия тиреоидных рецепторов в тканях гипофиза, печени и сердца. В этом аспекте орган зрения и/или орбитальные структуры практически не исследованы. Между тем, высоко ассоциативная связь между патологией щитовидной железы и офтальмопатологией не вызывает сомнений. Достаточно упомянуть болезнь Грейвса (БГ) и аутоиммунный тиреоидит (АИТ) и ассоциированную с ними эндокринную офтальмопатию (ЭОП).
Кроме того, популяция больных с заболеваниями щитовидной железы признана рядом группой риска развития глаукомы [6-13]. И, наконец, вполне закономерное следствие первичного гипотиреоза и/или тиреотоксикоза, зачастую не связанное с эндокринной офтальмопатией, - дистиреоидная оптическая нейропатия. Ее развитие эксперты объясняют гемодинамическими нарушениями в магистральных сосудах глаза, развивающимися на фоне гормонального дисбаланса [14-17]. Мы полагали, что есть более тесная связь, причины которой следует искать на морфологическом уровне.
Цель работы: поиск и идентификация тиреоидных рецепторов в структурах глазаметодом иммуногистохимического анализа (ИГХ).
Материал и методы.
Из-за сложностей получения донорских глаз, полученных post mortem, объектом морфологических исследований стали энуклеированные глаза больных терминальной болящей глаукомой (n=30).
Поиск тиреоидных рецепторов осуществляли в сетчатке и зрительном нерве, в сосудах хориоидеи и зрительного нерва
На первом этапе удаленные глаза подвергались обязательному морфологическому исследованию с целью подтверждения диагноза и уточнения характера патоморфологических изменений. С этой целью блок иссеченных тканей фиксировали в 10 % нейтральном формалине в течение 3-х суток. Макроскопический осмотр проводили после фиксации материала. Блоки, содержащие интересующие нас фрагменты тканей, заливались в парафин по традиционной методике. С каждого блока выполняли по 10 срезов толщиной 4-5 микрон, окрашивали их гематоксилин-эозином.
Просмотр препаратов и фоторегистрацию осуществляли под микроскопом “Opthon” с телевизионной приставкой при увеличении ×40, ×125, ×400.
На втором этапе на парафиновых срезах, предназначенных для стандартного морфологического исследования, проводили ИГХ анализ. Первичным антителом (АТ) служили АТ к тиреоидному рецептору THR alfa monoclonal (фирма «DiagnosticBioSystem», разведение 1: 50) .
Парафиновые срезы депарафинировали и регидратировали по стандартной методике. "Демаскировку" антигенов проводили путем 45-минутного прогревания срезов на водяной бане в предварительно нагретом до 95-990С цитратном буфере. Затем стекла охлаждали при комнатной температуре в течение 15-20 минут, и переносили в фосфатный буфер на 5 минут. Для блокирования эндогенной пероксидазы срезы инкубировали 20 минут в темноте с 3% перекисью водорода, приготовленной на дистиллированной воде, а затем промывали 5 минут в фосфатном буфере. Для блокирования неспецифического связывания АТ срезы инкубировали 15 минут с 1% раствором бычьего сывороточного альбумина. Инкубацию с первичными АТ проводили при 40С в течение 40 минут. После первичных АТ стекла промывали дважды по 5 минут в фосфатном буфере. Инкубацию со вторичными АТ [LSAB+kit, DAKO] проводили при комнатной температуре в течение 20 минут, затем срезы промывали дважды по 5 минут.
Инкубацию с АТ, меченными стрептавидином [LSAB+kit, DAKO], проводили при комнатной температуре в течение 20 минут, затем срезы промывали х 3 раза по 5 минут. Для визуализации ИГХ реакции использовали DAB+систему [BioGenex]. Реакцию проводили в течение 5-10 минут. Срезы докрашивали гематоксилином Майера и заключали в канадский бальзам.
Негативным контролем служила ИГХ реакция без добавления первичных АТ. Результаты окрашивания оценивали под увеличением х10, х20, х40 светового микроскопа «CarlZeiss» №984557 axiolabE-re (Германия). Для всех маркеров отмечали локализацию ИГХ-окрашивания в клетке (ядро, цитоплазма, мембрана).
ИГХ реакцию оценивали следующим образом:
- Отрицательной считали реакцию в отсутствие специфического окрашивания клеток или при наличии менее 10% окрашенных клеток от всей площади в зоне просмотра.
- Слабо положительной реакцией считали в случае окрашивания от 10 до 30% (+)клеток.
- Умеренно положительной считали реакцию в случае экспрессии маркера в 30 - 75 % (++) клетках.
- Экспрессию маркера более 75% клеток расценивали как выраженную реакцию (+++).
Результаты и обсуждение
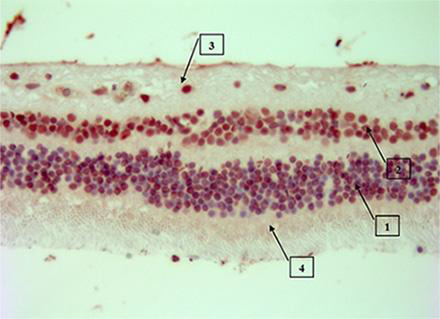
С помощью ИГХ-исследований было установлено, что различные структуры и ткани глаза экспрессируют тиреоидные рецепторы. В частности, интенсивная (4+) положительная ИГХ-окраска зафиксирована в ядрах наружного (1) и внутреннего зернистого (2) слоев сетчатки, в ядрах ганглиозных клеток (3); слабоположительная окраска (1+) во внутренних сегментах отростков фоторецепторных клеток (4) (Рис.1) .
Рис. 1. ИГХ-окраска сетчатки THR alfa monoclonal (1- наружный зернистый слой; 2 – внутренний зернистый слой; 3 – слой ганглиозных клеток; 4 - внутренние сегменты
отростков фоторецепторных клеток).
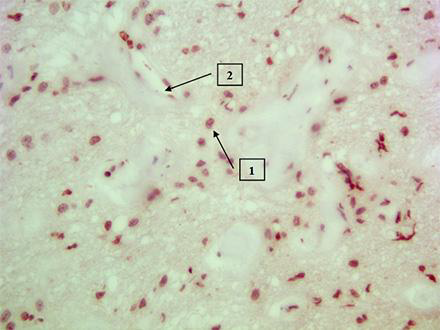
Гранулярная ИГХ-окраска (3+) обнаруживалась в ядрах глиальных элементов зрительного нерва (1) (рис. 2).
Рис. 2. ИГХ-окраска зрительного нерва THR alfa monoclonal (1- ядра глиальных элементов зрительного нерва; 2 - ядра эндотелиоцитов сосудов , питающих нерв).
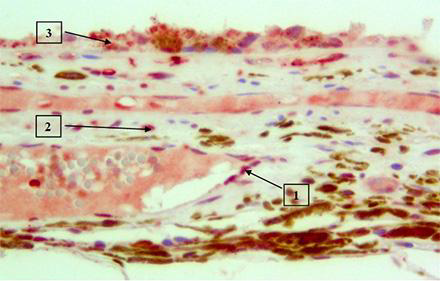
В хориоидее окрашивались ядра эндотелиоцитов (1) и ядра 20% клеток стромы (2) сосудистой оболочки. ИГХ-реакция, интенсивностью 3+, отмечалась в цитоплазме клеток пигментного эпителия сетчатки (3) (рис. 3).
Рис. 3. ИГХ-окраска хориоидее THR alfa monoclonal (1- ядра эндотелиоцитов; 2 - ядра клеток стромы; 3 - пигментный эпителий сетчатки).
Заметим, наряду с эндотелием сосудов хориоидеи, THR рецепторы экспрессировали ядра эндотелиоцитов стенки сосудов, питающих зрительный нерв (2) (рис. 2).
Результаты проведенных нами исследований имеют научно-практическое значение для практикующих офтальмологов, эндокринологов, а также морфологов. При обращении к справочной литературе нам не удалось найти сведений о том, что глаз является гормончувствительным органом или органом-мишенью. Как известно, характерным признаком органа–мишени является его способность считывать информацию, закодированную в гормоне, с помощью рецепторов. Следовательно, именно обнаружение тиреоидных рецепторов в этих орбитальных структурах определяет их статус «органа-мишени».
Проведенный нами ИГХ-анализ позволил идентифицировать структуры глаза и клетки, метаболический гомеостаз которых зависит от уровня тиреоидных гормонов с одной стороны, и, уровня экспрессии тиреоидных рецепторов, с другой стороны. Как видно из представленных данных, периферический отдел зрительного анализатора, включая сетчатку и зрительный нерв, являются мишенями тиреоидных гормонов. Интенсивная THR-экспрессия в наружном и внутреннем зернистом слоях сетчатки, ганглиозных клетках и внутренних сегментах отростков фоторецепторных клеток объясняет механизмы развития дистиреоидной оптической нейропатии при заболеваниях щитовидной железы, проявляющихся гипотиреозом и/или тиреотоксикозом, в отсутствие эндокринной офтальмопатии. В совокупности представленные результаты подтверждают единство нейрогуморальной регуляции. Под термином «нейрогуморальная» регуляция, мы понимаем сложный физиологический процесс с момента передачи фотона света на первый нейрон зрительного анализатора до анализа изображения предмета.
Экспрессия тиреоидных рецепторов в эндотелиальных и гладкомышечных клетках сосудов хориоидеи и зрительного нерва свидетельствует о том, что, наряду с прямым влиянием тиреоидных гормонов на сетчатку и зрительный нерв, возможно опосредованное влияние за счет развивающихся гемодинамических нарушений, вызванных заболеванием щитовидной железы. Известно, что тиреоидные гормоны влияют на гемодинамику, увеличивая объем циркулирующей крови, регулируя сосудистый тонус и сосудистую сопротивляемость, а также сердечный выброс. В зависимости от избытка или недостатка гормонов, кровоток в различных компартментах человеческого организма может усиливаться или ослабевать, приводя к ишемии и гипоксии органов. Как показывают наши морфологические данные, в этом аспекте, орган зрения, не является исключением из общего правила. Многочисленные работы подтверждают электрофизиологическими методами факт развития оптической нейропатии в отсутствие признаков компрессионной эндокринной офтальмопатии у больных первичных гипотиреозом и тиреотоксикозом [8]. Наряду с этим, доказана прямая корреляционная связь между глубиной зрительных дисфункций и уровнем гемодинамических нарушений кровотока в магистральных сосудах глаза и орбиты. Полученные нами ИГХ-данные объясняют механизм этой связи и морфологически обосновывают причины морфофункциональных изменений периферического отдела зрительного анализатора при заболеваниях щитовидной железы.
Выводы
Обнаруженная экспрессия тиреоидных рецепторов в наружном и внутреннем зернистом слоях сетчатки, ганглиозных клетках и внутренних сегментах отростков фоторецепторных клеток демонстрирует нейрогуморальную связь на клеточном уровне и позволяет считать сетчатую оболочку глаза – мишенью тиреоидных гормонов.
Экспрессия тиреоидных рецепторов в эндотелиальных и гладкомышечных клетках сосудов хориоидеи и зрительного нерва свидетельствует о том, что, наряду с прямым влиянием тиреоидных гормонов на сетчатку и зрительный нерв, возможно опосредованное влияние за счет гемодинамических нарушений, вызванных дисфункциями щитовидной железы.
Полученные нами ИГХ-данные объясняют механизм глаз-тиреоидной ассоциативной связи и морфологически обосновывают причины морфофункциональных изменений периферического отдела зрительного анализатора при заболеваниях щитовидной железы, сопровождающихся гипотиреозом или тиреотоксикозом.
Литература
1. Ткачук В.А. Введение в молекулярную эндокринологию. М.: МГУ; 1983.
2. Вицлеб Э. Функции сосудистой системы. М.: Мир; 1985.
3. Провоторов В.М. Тиреоидные гормоны и нетиреоидная патология. Российский Медицинский Журнал. 2002; 5: 30-33.
4. Петунина Н.А. Особенности терапии заболеваний щитовидной железы у пациентов с кардиальной патологией. Российский Медицинский Журнал. 2005; 13(28): 1927-1932.
5. Дедов И.И., Мельниченко Г.А., Фадеев В.В. Эндокринология. М.: ГЭОТАР- медиа; 2007.
6. Lee A.J., Rochtchina E., Mitchell P. Intraocular pressure asymmetry and undiagnosed open-angle glaucoma in an older population. Am J Ophthalmol. 2004; 137(2): 380–382.
7. Lee T.J., Rang M.H., Hong J,P. Three-wall orbital decompression in Graves' ophthalmopathy for improvement of vision. J CraniomaxillofacSurg. 2003; 14(4): 500–503.
8. Ohtsuka K., Nakamura Y. Open-angle glaucoma associated with Graves disease. Am J Ophthalmol. 2000; 129: 613–617.
9. Киселева Т.Н., Пантелеева О.Г., Шамшинова А.М. Кровоток в сосудах глаза и орбиты у больных эндокринной офтальмопатией. Вестникофтальмологии. 2007; 1: 33– 36.
10. Berges O., Koskas P., Lafitte F., Piekarsski J.-D. Sonography of the eye and orbit with a multipurpose ultrasound unit. J Radiol.2006; 87: 345–353.
11. Gillow J.T., Shah P., O'Neill E.C. Primary open angle glaucoma and hypothyroidism: chance or true association? Eye. 1997; 11: 113–114.
12. Ohtsuka K., Nakamura Y. Open-angle glaucoma associated with Graves' disease. Am J Ophthalmol. 2000; 129: 613–617.
13. АлешаевМ.И. Факторы риска развития первичной открытоугольной глаукомы. П.: ГОУДПОПИУ; 2009.
14. Feldon S.E., Muramatsu S., Weiner J. M. Clinical classification of Graves' ophthalmopathy. Identification of risk factors for optic neuropathy. Arch. Ophthalmol. 1984; 102(10): 1469-1472.
15. Пантелеева О.Г. Современная концепция механизма развития нарушений зрительных функций при эндокринной офтальмопатиии. Международный эндокринологический журнал. 2010; 3(27): 35-45.
16. Алексеев И.Б., Алескерова П.М., Дзиова Ф.С., Мослехи Ш. Особенности внутриглазной гемодинамики у больных эндокринной офтальмопатией. Глаукома. 2010; 2: 3-7.
17. Мамиконян В.Р., Галоян Н.С., Шеремет Н.Л., Казарян Э.Э., Харлап С.И., Шмелева-Демир О.А., Анджелова Д.В., Татевосян А.А. Особенности глазного кровотока при ишемической оптической нейропатии и нормотензивной глаукоме. Вестник Офтальмологии. 2013; 4: 3-8.